Équipe 3
Équipe 3
Dopamine et assemblées neuronales
LE BON-JEGO Morgane (MCF ) LADEVEZE Elodie (Ingénieure d'étude) GARCIA BAOS Alba (Post-doctorante) GLANGETAS Christelle (Post-doctorante) GUILLAUMIN Adriane (Post-doctorante) SIERRA Teresa (Post-doctorante) BONAMY Léa (Doctorante) DE LAS HERRAS-GARCIA Laura (Doctorante) PERROT Emma (Doctorante) SCHARNHOLZ Jakob (Doctorant) VILLACANA-MUNOZ Viviana (Doctorant)
Pour plus d’informations, veuillez contacter
Dr Jérôme BAUFRETON
jerome.baufreton@u-bordeaux.fr
Dr François GEORGES.
Thématique de Recherche
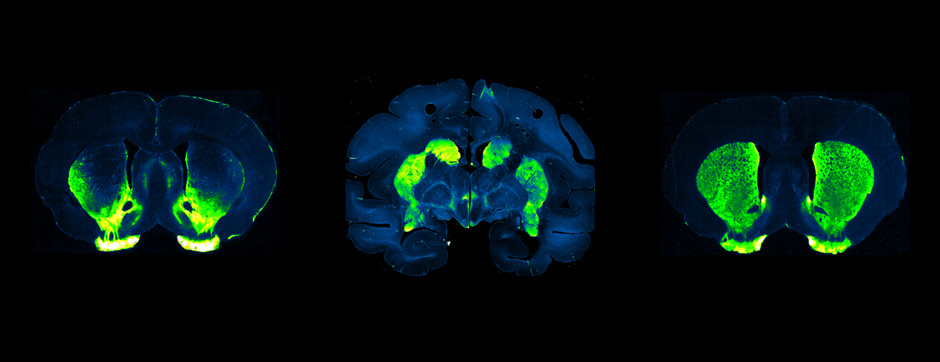
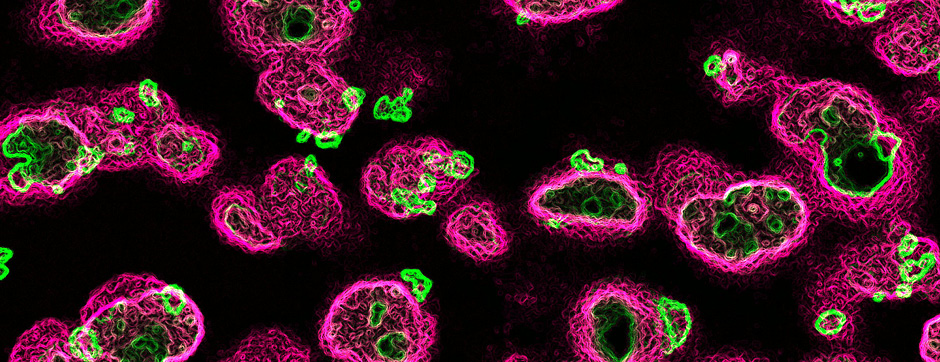
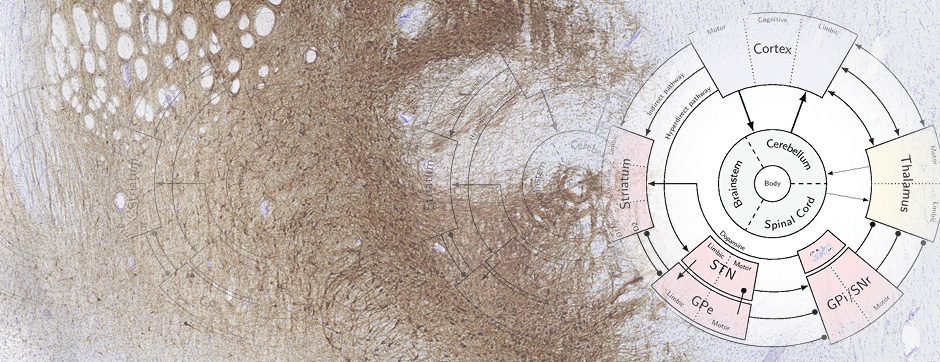
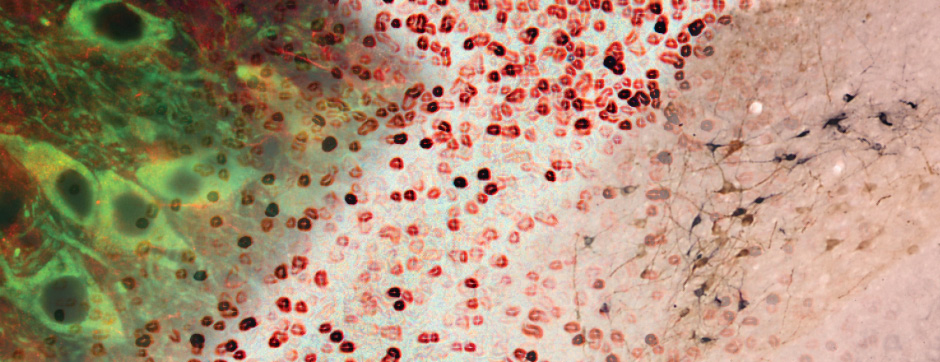
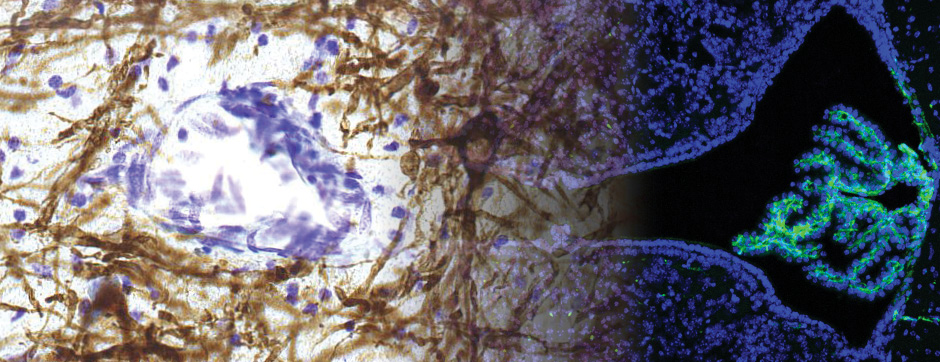
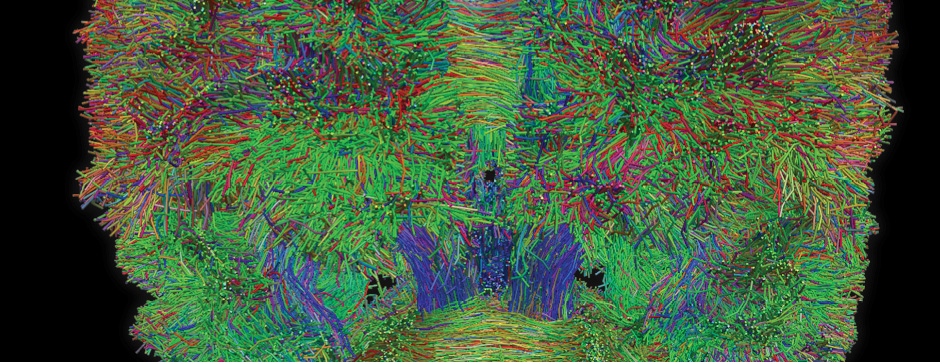
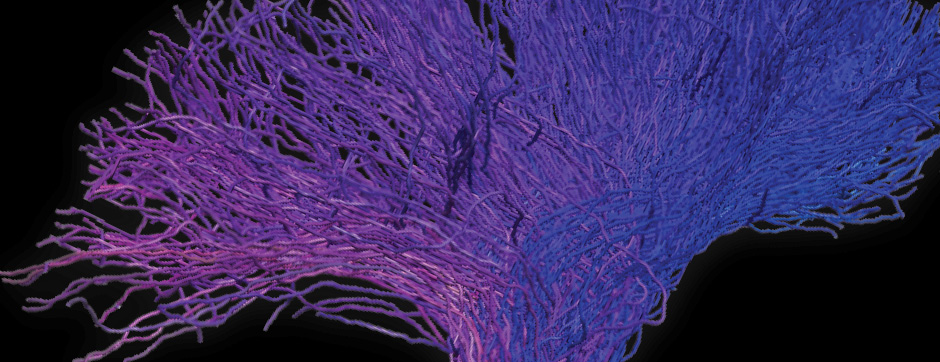
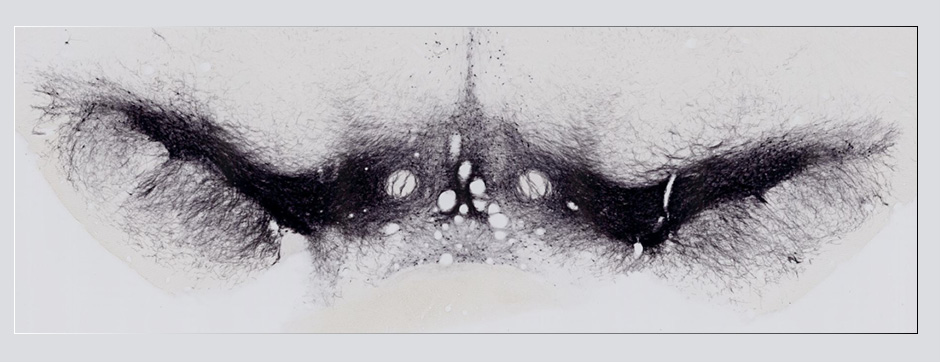
Le mouvement et l’émotion sont intimement liés. L’objectif principal de nos recherches est de déterminer les fonctions de la dopamine dans le « réseau étendu des ganglions de la base » (« extended basal ganglia network » (EBG). L’EBG est un circuit neuronal contrôlant le mouvement et les états émotionnels (mouvement volontaire, apprentissage associatif, comportement exploratoire par le traitement d’informations sensorielles, stress), mais il est également impliqué dans des troubles neurologiques et psychiatriques (maladie de Parkinson, maladie de Huntington, anxiété). L’objectif de notre équipe est d’établir une base de connaissances permettant de définir des pistes thérapeutiques pour traiter les symptômes des maladies neurologiques et psychiatriques liées au système dopaminergique. Nous nous intéressons particulièrement au contrôle de la transmission synaptique et de la plasticité par la dopamine.
Nous étudions ces mécanismes au niveau de la synapse, de la cellule, du circuit neuronal et du comportement. Nous combinons des technologies de pointe, telles que : l’électrophysiologie in et ex vivo (couplée à l’identification cellulaire après marquage de cellules uniques), des approches virales intersectionnelles pour identifier (traçage), manipuler (optogénétique, chemogénétique) et enregistrer (endoscopic imaging & fiberphotometry) l’activité neuronale (imagerie calcique) ou la libération de dopamine (senseur à dopamine) chez des animaux engagés dans une tâche comportementale. Par l’utilisation de ces techniques innovantes, notre objectif est de mieux comprendre comment des sous-ensembles définis de neurones de l’EBG codent des aspects du mouvement et de l’émotion.
Dernières publications
Criteria : Author : "Jérome,Baufreton; François,Georges", Publication type : "('ART')"
Number of occurrences founded : 86.
- titre
- GAP43 Located on Corticostriatal Terminals Restrains Novelty-Induced Hyperactivity in Mice
- auteur
- Irene Maroto, Carlos Costas-Insua, Carlos Montero-Fernández, Alba Hermoso-López, Margaux Lebouc, Raquel Bajo-Grañeras, Alicia Álvaro-Blázquez, Cristina Blázquez, Astrid Cannich, Giovanni Marsicano, Ricardo Martín, Jérôme Baufreton, Ignacio Rodríguez-Crespo, Luigi Bellocchio, Manuel Guzmán
- article
- Journal of Neuroscience, 2024, 44 (39), pp.e0701242024. ⟨10.1523/JNEUROSCI.0701-24.2024⟩
- identifiant
- hal-04727363
- titre
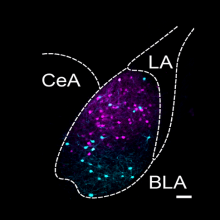
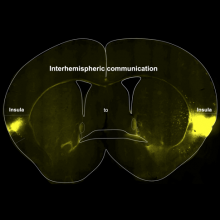
- A population of Insula neurons encodes for social preference only after acute social isolation in mice
- auteur
- Christelle Glangetas, Adriane Guillaumin, Elodie Ladevèze, Anaelle Braine, Manon Gauthier, Léa Bonamy, Evelyne Doudnikoff, Thibault Dhellemmes, Marc Landry, Erwan Bézard, Stephanie Caille, Anne Taupignon, Jérôme Baufreton, François Georges
- article
- Nature Communications, 2024, 15 (1), pp.7142. ⟨10.1038/s41467-024-51389-4⟩
- identifiant
- hal-04681539
- titre
- Nucleus accumbens D1- and D2-expressing neurons control the balance between feeding and activity-mediated energy expenditure
- auteur
- Roman Walle, Anna Petitbon, Giulia R Fois, Christophe Varin, Enrica Montalban, Lola Hardt, Andrea Contini, Maria Florencia Angelo, Mylène Potier, Rodrigue Ortole, Asma Oummadi, Véronique de Smedt-Peyrusse, Roger A Adan, Bruno Giros, Francis Chaouloff, Guillaume Ferreira, Alban de Kerchove D’exaerde, Fabien Ducrocq, François Georges, Pierre Trifilieff
- article
- Nature Communications, 2024, 15 (1), pp.2543. ⟨10.1038/s41467-024-46874-9⟩
- identifiant
- hal-04670379
- titre
- Age-Dependent Modulation of Layer V Pyramidal Neuron Excitability in the Mouse Primary Motor Cortex by D1 Receptor Agonists and Antagonists
- auteur
- Valentin Plateau, Jérôme Baufreton, Morgane Le Bon-Jégo
- article
- Neuroscience, 2024, 536, pp.21-35. ⟨10.1016/j.neuroscience.2023.11.006⟩
- identifiant
- hal-04742029
- titre
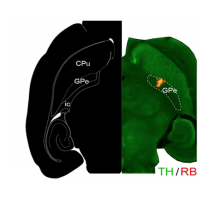
- Spatiomolecular Characterization of Dopamine D2 Receptors Cells in the Mouse External Globus Pallidus
- auteur
- Julie Espallergues, Jihane Boubaker-Vitre, Audrey Mignon, Maelle Avrillon, Morgane Le Bon-Jego, Jerome Baufreton, Emmanuel Valjent
- article
- Current Neuropharmacology, In press, 22 (9), pp.1528-1539. ⟨10.2174/1570159X21666230720121027⟩
- identifiant
- hal-04181821